问题
选择题
在不同温度下,水达到电离平衡时c(H+)与c(OH—)的关系如图4所示,下列说法中正确的是
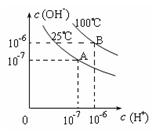
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和,所得溶液的pH等于7
B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7
C.25℃时, 0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7
答案
答案:D
题目分析:100℃时,pH=12的NaOH溶液浓度是1mol/L,所以反应后氢氧化镍是过量的,溶液显碱性,A不正确;B中氢氧化钡是过量的,溶液显碱性,B不正确;C中恰好反应,但生成的醋酸钠水解,溶液显碱性,C不正确;D中氨水过量,溶液显碱性,D正确,答案选D。
点评:该题溶液错选A。这是由于没有考虑到水的离子积常数是随温度的升高而增大的,因此在100℃时,pH=6时,溶液是显中性的。因此在利用pH判断溶液酸碱性时,需要注意溶液的温度。
