(6分) 在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器中,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
 时间 (s)浓度 mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
根据表格提供数据,请回答下列各小题:
⑴该反应的化学方程式为:
表示C2 C3 C4 (填 < , > 或 = )
⑵ 20S时,四氧化二氮的浓度C1=
在0~20 S内四氧化二氮的平均反应速度为
(1) N2O4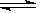 2NO2 C2 > C3 = C4
2NO2 C2 > C3 = C4
(2)0.14mol/L 0.003mol/(L·s)
(1)根据表中数据可判断,平衡时NO2的浓度是0.22mol/L,根据反应式可知消耗N2O4的浓度应是0.11mol/L,所以平衡时N2O4的浓度是0.20mol/L-0.11mol/L=0.09mol/L。即C3=C4=0.09mol/L。反应进行到40s时N2O4的浓度是0.10mol/L,则消耗N2O4的浓度是0.20mol/L-0.10mol/L=0.10mol/L,所以此时生成的NO2浓度是0.20mol/L,即C2=0.20mol/L。
(2)20s时NO2的浓度是0.12mol/L,根据反应式可知消耗N2O4的浓度应是0.06mol/L,所以剩余N2O4的浓度是0.20mol/L-0.06mol/L=0.14mol/L。在0~20s内四氧化二氮的平均反应速度为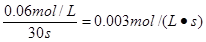 。
。
