问题
选择题
水的电离过程为H2O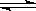 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是 ( )
A.c(H+)随着温度升高而升高
B.35℃时,c(H+)>c(OH-)
C.水的电离度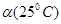 <
<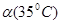
D.水的电离是吸热的
答案
答案:B
题目分析:根据不同温度下水的离子积可知升高温度,平衡正向移动,所以水的电离是吸热的,c(H+)、c(OH-)随着温度升高而升高,但c(H+)=c(OH-),所以B项错误。答案选B。
点评:温度升高水的电离程度增大,但是c(H+)=c(OH-),溶液呈中性。
