现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,回答下列问题:
(1)甲溶液的pH= ;
(2)丙溶液中存在的电离平衡为(用电离平衡方程式表示) ;
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为 ;
(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
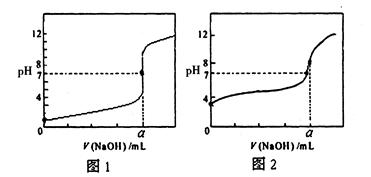
①甲溶溶液滴定丙溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(共10分)(1)13 (2分)(2)CH3COOH CH3COO-+H+ H2O
CH3COO-+H+ H2O OH-+H+(2分)
OH-+H+(2分)
(3)丙>甲=乙 (2分) (4)①图2 (2分) ②20.00 (2分)
题目分析:(1)氢氧化钠是强碱,所以溶液中氢离子浓度是1×10-13mol/L,则溶液的pH=13。
(2)醋酸和水都是弱电解质,存在电离平衡,所以电离方程式分别是CH3COOH CH3COO-+H+、H2O
CH3COO-+H+、H2O OH-+H+。
OH-+H+。
(3)酸或碱都是抑制水的电离平衡的,且溶液中氢离子或OH-浓度越大,对水的电离的抑制程度越大。所以根据酸碱的浓度可知,甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为丙>甲=乙。
(4)①0.1mol/L溶液的pH大于1,所以图2表示甲溶溶液滴定丙溶液的曲线。
②盐酸和氢氧化钠恰好反应时,溶液显中性,所以根据酸碱的浓度以及盐酸的体积可知,消耗氢氧化钠溶液的体积是20.00ml,即a=20.00ml。
点评:该题属于中等难度的试题,重点考查学生对电离平衡的理解以及灵活运用知识解决实际问题的能力。需要注意的是第(2)问中学生有可能漏掉水的电离平衡方程式,要引起注意。
