(14分)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)  2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
2SO3(g) △H< 0。查阅资料知SO3熔点16.83℃,沸点44.8℃。
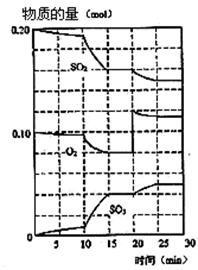
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3物质的量变化如图。
①该反应的化学平衡常数表达式 K=
②该反应能自发进行的原因是 。
③据图判断,该反应处于平衡状态的时间是 。
④据图判断,反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。
(2)某化学研究学习小组用下图的装置组装设计了一个实验,以测定SO2转化为SO3的转化率,仪器的连接顺序是a→h→i→b→c→f→g→d→e。
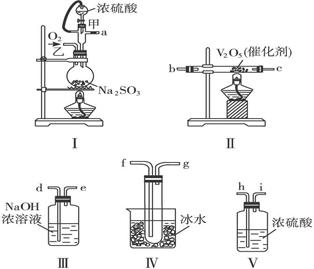
①为提高SO2的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
②在Ⅰ处用大火加热烧瓶时SO2的转化率会 。(填“填大”“不变”或“减小”)
③用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为 。
(1)①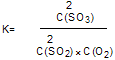 ②该反应是放热反应
②该反应是放热反应
③15—20 25—30 ④增大氧气的浓度(或物质的量)
(2)①先加热Ⅱ处催化剂 ②减小 ③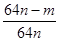 ×100%
×100%
(1)①平衡常数是指可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的平衡常数表达式为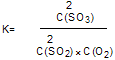 。
。
②由于反应是放热反应,所以是可以自发进行。
③平衡时正逆反应速率是相等,因此物质的浓度是不变的,所以根据图像可判断,处于平衡状态的是15—20min和25—30min。
④由图像可以看出,在20min时,氧气的浓度突然变大,而SO2和三氧化硫的物质的量不变。随后三氧化硫的物质的量逐渐增大,氧气和二氧化硫的物质的量逐渐减小。这说明是通过增大氧气的浓度,使平衡向正反应方向移动的。
(2)①Ⅰ是制备二氧化硫的,Ⅱ是氧化二氧化硫的,所以为了提高二氧化硫的转化率,应该是先加热Ⅱ处催化剂,然后再滴入浓硫酸。
②在Ⅰ处用大火加热,则二氧化硫的生成速率过快,氧化二氧化硫的效率就底,转化率就降低。
③Ⅲ是用来吸收没有反应的二氧化硫,n mol Na2SO3可生成n mol二氧化硫,设转化率是x,则(n-nx)×64=m,解得x=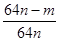 。
。
