某溶液中只存在OH-、H+、Cl-、NH4+ 四种离子,其离子浓度可能有如下关系。下列说法正确的是
①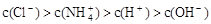 ②
②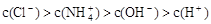
③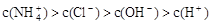 ④
④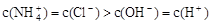
A.若①正确,则溶液中溶质一定为NH4Cl
B.溶质不同时,上述四种关系式均可能成立
C.若④正确,且混合前盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-)
D.若③正确,则溶液中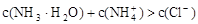
答案:D
题目分析:A项:也可能是NH4Cl和NH3.H2O的混合溶液,故A错。B项:②关系式违反了电荷守恒,即溶液中电荷总数为0的规则,因此②关系式不肯能成立,故B错。C项:④关系式是溶液呈中性,即氨水略过量,溶质就应该是2种,NH4Cl和NH3.H2O,盐酸属于强电解质,会完全电解;氨水是弱电解质,不完全电解。当c(OH-)=c(H+).那么氨水的浓度一定低于盐酸的浓度。因为不完全电解的关系,所以在混合前,氨水的|PH-7|<盐酸的|PH-7|。所以,盐酸中的c(H+)一定大于氨水中的c(OH-),故C错。故选D。
点评:本题考查了电离平衡、盐的水解平衡的知识点,弱解质的电离平衡及盐类的水解平衡是高考的热点内容之一,也是学习中的重点和难点。应多加练习。电离平衡是指弱电解质分子电离出离子的速率不断降低,而离子重新结合成弱电解质分子的速率不断升高,当两者的反应速率相等时,溶液便达到了电离平衡。此时,溶液中电解质分子的浓度与离子的浓度分别处于相对稳定状态,达到动态平衡。盐的水解反应是指凡是组成盐的离子与水作用产生弱酸或弱碱,并改变溶液酸度的反应都叫做盐的水解反应。当电离平衡,盐的水解反应共存时,(1)具体问题,具体分析!(2)NaHCO3---水解平衡程度 > 电离平衡!PH > 7(3)NaHSO3---水解平衡程度 < 电离平衡!PH < 7。
