问题
选择题
常温下,0.1mol/LCH3COOH溶液中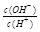 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10mol/L
B.该溶液中醋酸的电离度为1%
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.溶液中c(H+)+c(CH3COO-)=0.1 mol/L
答案
BC
题目分析:常温下,0.1mol/LCH3COOH溶液中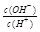 =1×10-8,则根据水的离子积常数可知,溶液中氢离子浓度是c(H+)=10-3mol/L。醋酸抑制水的电离,所以溶液中水电离出的c(H+)=10-11mol/L,A不正确;该溶液中醋酸的电离度为
=1×10-8,则根据水的离子积常数可知,溶液中氢离子浓度是c(H+)=10-3mol/L。醋酸抑制水的电离,所以溶液中水电离出的c(H+)=10-11mol/L,A不正确;该溶液中醋酸的电离度为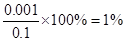 ,B正确;溶液中加入一定量CH3COONa晶体抑制醋酸的电离,溶液的c(OH-)增大。稀释促进电离,氢离子的物质的量增加,但氢离子但浓度降低,所以溶液的c(OH-)增大,C正确;D不正确,应该是c(CH3COOH)+c(CH3COO-)=0.1 mol/L,答案选BC,
,B正确;溶液中加入一定量CH3COONa晶体抑制醋酸的电离,溶液的c(OH-)增大。稀释促进电离,氢离子的物质的量增加,但氢离子但浓度降低,所以溶液的c(OH-)增大,C正确;D不正确,应该是c(CH3COOH)+c(CH3COO-)=0.1 mol/L,答案选BC,
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确醋酸的电离平衡特点以及影响因素,然后灵活运用即可。
