(共8分)在恒温恒容的密闭容器中通入1mol N2和Xmol H2发生如下反应:N2+3H2 2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
2NH3。达到平衡后,测得反应放出的热量为18.4kJ,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%。
(1)起始时充入H2的物质的量为 mol,氢气的转化率为 ;
(2)该反应的热化学方程式为 ;
(3)若起始时加入N2、H2、NH3的物质的量分别为a、b、c,达到平衡时各组分物质的量与上述平衡相同。若维持反应向正方向进行,则起始时c的取值范围是 。
(1)3 20%
(2)N2(g)+3H2(g)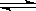 2NH3(g) ΔH=-92.0kJ/mol (3) 0 mol≤c<0.4mol
2NH3(g) ΔH=-92.0kJ/mol (3) 0 mol≤c<0.4mol
(1)因为压强之比是物质的量之比,所以反应前气体的物质的量是3.6mol÷0.9=4.0mol,因此氢气的物质的量是4mol-1mol=3mol。设消耗氮气的物质的量是amol,则消耗氢气是3amol,生成氨气是2amol,因此有1.0mol-amol+3.0mol-3amol+2amol=3.6mol,解得a=0.2mol,所以氢气的转化率是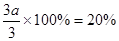 。
。
(2)由(1)可知消耗0.2mol氮气,放出的热量是18.4kJ,因此消耗1mol氮气放出的热量就是18.4kJ×5=92.0kJ,所以热化学方程式为N2(g)+3H2(g)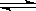 2NH3(g) ΔH=-92.0kJ/mol。
2NH3(g) ΔH=-92.0kJ/mol。
(3)根据(1)可知,平衡时生成氨气是0.4mol,所以要使反应向正方向进行,则起始时c的取值范围是0 mol≤c<0.4mol。
