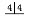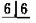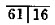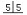某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00 mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理 。
(2)从上述实验步骤中选出正确的并按操作先后排序。你的实验顺序为:(用字母
表示) 。
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是________,
理由是_______________________________________________________________ ;
滴定终点的现象是______________________________________________________。
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH) /mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH) /mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空。
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡_______;
②读取标准溶液体积时,滴定前平视,滴定后仰视________。
(1)CH3COOH + OH- = CH3COO- + H2O (2)G→D→A→F→B→H→C
(3)酚酞,两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;无色溶液变浅红色且半分钟内不褪色(4) 0.07500 (5)①偏低 ②偏高
题目分析:氢氧化钠与醋酸生成醋酸钠和水,醋酸是弱酸,书写离子方程式时不能拆开。滴定时操作步骤为:滴定管查漏→水洗→润洗→注液、调节液面→排气泡、记录刻度→注入待测液→滴定至终点读数。醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞),终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色。五次实验消耗氢氧化钠溶液体积分别为15.75mL、15.00mL、14.98mL、15.02mL、15.00mL,其中15.75mL误差太大,应舍弃,所以氢氧化钠溶液体积平均为15.00mL,氢氧化钠溶液浓度为0.1mol/L,醋酸体积为20.00mL,由n(NaOH)=n(CH3COOH)得醋酸物质的量浓度为0.07500mol/L。滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡,则氢氧化钠溶液体积偏小,醋酸浓度偏小;读取标准溶液体积时,滴定前平视、滴定后仰视,则氢氧化钠溶液体积偏大,醋酸浓度偏大。
点评:滴定时,锥形瓶不能待装液体润洗。分析误差时,关键是分析滴定管中氢氧化钠溶液的体积,若氢氧化钠溶液体积偏大,则所测醋酸浓度偏大。