(9分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010. | 0.008 | 0.007 | 0. 007 | 0.007 |
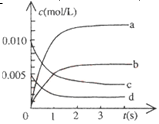
⑵下图中表示NO2的浓度变化曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v (NO2)="2" v (O2) b.容器内压强保持不变
c.v逆 (NO)="2" v正 (O2) d.容器内混合气体的密度保持不变
e.该容器内颜色保持不变
(1)65% (2分) (2)b (2分)
(3)0.0015mol·L-1·S-1 (2分) (4)b、c、e (3分)
(1)根据表中数据可判断,平衡时NO的物质的量是0.007mol,所以消耗的NO是0.020mol-0.007mol=0.013mol,所以转化率是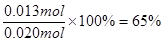 。
。
(2)NO2是生成物,平衡时生成NO2是0.013mol,浓度是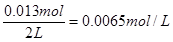 ,所以曲线b表示NO2的浓度变化曲线。
,所以曲线b表示NO2的浓度变化曲线。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色的深浅和浓度大小有关系,所以选项e正确。A中速率的关系是恒成立的,不能说明。反应前后体积是变化的,所以压强也是变化的,因此当压强不再发生变化时,可以说明。C中反应速率的方向是相反的,且满足速率之比是相应的化学计量数之比,正确。混合气的密度是混合气的质量和容器容积的比值,在反应过程中,质量和容积都是不变的,所以密度始终是不变的,d不能正确。答案选bce。
