已知圆C:(x-3)2+(y-4)2=4,直线l1过定点A(1,0).
(1)若l1与圆相切,求l1的方程;
(2)若l1与圆相交于P、Q两点,线段PQ的中点为M,又l1与l2:x+2y+2=0的交点为N,判断AM·AN是否为定值?若是,则求出定值;若不是,请说明理由.
(1)x=1或3x-4y-3=0(2)6
(1)①若直线l1的斜率不存在,即直线是x=1,符合题意.
②若直线l1斜率存在,设直线l1为y=k(x-1),即kx-y-k=0.
由题意知,圆心(3,4)到已知直线l1的距离等于半径2,即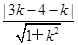 =2,解得k=
=2,解得k=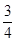 .
.
∴所求直线方程是x=1或3x-4y-3=0.
(2)(解法1)直线与圆相交,斜率必定存在,且不为0,可设直线方程为kx-y-k=0.
由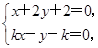 得N
得N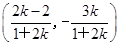 .又直线CM与l1垂直,
.又直线CM与l1垂直,
由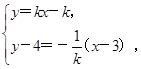 得M
得M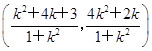 .
.
∴AM·AN=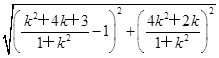 ·
·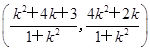
=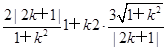 =6为定值.
=6为定值.
故AM·AN是定值,且为6.
(解法2)直线与圆相交,斜率必定存在,且不为0,可设直线方程为kx-y-k=0.
由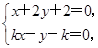 得N
得N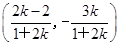 .再由
.再由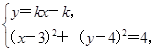
得(1+k2)x2-(2k2+8k+6)x+k2+8k+21=0.
∴x1+x2=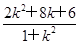 ,得M
,得M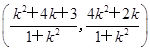 .
.
以下同解法1.
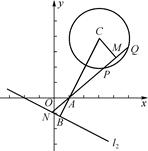
(解法3)用几何法
连结CA并延长交l2于点B,kAC=2,kl2=-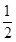 ,
,
∴CB⊥l2.如图所示,△AMC∽△ABN,则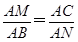 ,
,
可得AM·AN=AC·AB=2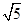 ·
·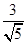 =6,是定值
=6,是定值
