问题
选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
C.V(NaOH)<10 mL时,可能存在c(Na+)=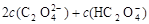
D.V(NaOH)>10 mL时,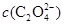 >
>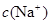 >
>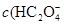 )
)
答案
答案:C
题目分析:A、由于草酸根是弱酸跟离子,所以不能完全电离出氢离子,V(NaOH)=0时,c(H+)<1×10-2 mol/L故错。
B. V(NaOH)=10 mL时,由于草酸氢钠溶液过量,所以溶液溶液呈酸性,c(H+)>1×10-7 mol/L
C. V(NaOH)<10 mL时,根据物料守恒可知,可能存在c(Na+)=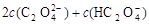
D.V(NaOH)>10 mL时,溶液中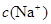 >
>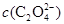 >
>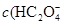 )故错。
)故错。
点评:本题难度大,主要考察溶液中弱酸根离子的水解作用,溶液过量问题,加入碱的量会使水解平衡移动。
