(16分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)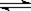 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
(1) K=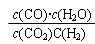 (2)吸热 (3)bc (4) 830℃(4分/每空)
(2)吸热 (3)bc (4) 830℃(4分/每空)
平衡常数是指在一定条件下的可逆反应中,当反应达到化学平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值是平衡常数,所以该反应的平衡常数表达式为K=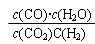 .
.
(2)随着温度的升高,平衡常数逐渐增大,说明升高温度平衡向正反应方向移动,因此正反应是吸热反应.
(3) 在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以b正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此d不正确.由于反应前后体积不变,所以压强始终是不变的,a不正确.c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确.所以答案是bc.
(4)如果c(CO2)·c(H2)=c(CO)·c(H2O),则此时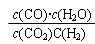 =1,所以温度是830℃.
=1,所以温度是830℃.
