(10分) (1)已知某反应的各物质浓度数据如下:
_ 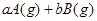

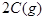
起始浓度(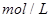 ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度(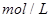 ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a= ,b= 。
②2s内B的转化率= 。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有 mol电子从 通过电线到 (填“铁片”或“碳棒”)。
④此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是 (用含m的代数式表示。)
(1)①a=3(1分),b=1(1分)。 ② 20% (1分)。
(2)③ 0.3mol (1分) 铁片(1分)碳棒。(1分) ④ 1.5mol/L(1分)。
(3) 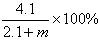 (3分)。
(3分)。
(1)①因为物质的量的变化量之比是相应的化学计量数之比,所以a和b的比值是0.6︰0.2=3︰1。
②2S内B的转化率为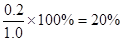
(2)原电池中较活泼的金属作负极,电子经导线传递到正极。碳棒是正极,氢离子得到电子,氢气是3.36L,物质的量为3.36L÷22.4L/mol=0.15mol,所以转移电子是0.15mol×2=0.3mol。此时溶液中的氢离子是0.2L×1.5mol/L×2=0.6mol,则溶液中氢离子的物质的量浓度为
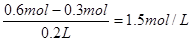 。
。
(3)2.3g钠是0.1mol。生成D2是0.05mol,质量是0.05mol×4g/mol=0.2g。所以氢氧化钠的质量分数为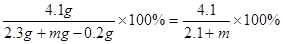 。
。
