阅读下面的文字,完成小题。(25分)
坚守的胡杨
李首峰
胡杨生存的环境,多为缺雨少食的荒漠之地,被视为生命的“禁区”和“绝境”。胡杨却选择在这样的地方安家落户,生儿育女,创造大漠的繁荣。
许多生命以为,胡杨是浸泡在苦难里的生命,表示莫大的同情和怜悯。其实,胡杨对“苦”有自己的理解和认识。胡杨认为,“甜”有多种表现形式,自己遇到的“苦”其实是“甜”的一种,是一种特殊的“甜”,是一种奇怪的“甜”,这种“甜”的营养价值举世罕见,弥足珍贵。
面对逆境和苦难,生命纷纷出逃,而胡杨选择了坚守。胡杨的坚守不是死守,是智慧地坚守。戈壁荒漠干旱少雨,植物降生的机会很少、也很小。机会虽少,但不等于没有。机会虽小,但不等于不能成事。关键在于对机遇识别的能力和抢抓机遇的能力,关键在于抢抓机遇的速度和效率。胡杨把自己的种子装上翅膀,随时做好起飞的准备。生命一旦装上了翅膀,也就不受原有环境的局限了,带翅膀的生命可以穿越不同的时空。胡杨带翅膀的种子在空中翱翔,满天都是胡杨侦察机,对于大地上的生机,胡杨定位准,俯冲快,哪里一旦被雨洒落的甘霖浸润,胡杨便以惊人的速度落地生根,根以极快的速度向下掘进。胡杨在少儿时代,不求长得快,但求把根儿扎得深,根只要能与地母的血脉连在一起,任何营养都不缺了。根只要四通八达,体系健全,再大的风,胡杨也不惧了。
干旱无雨的季节,是胡杨生活困难的时日。但胡杨早已订好应对的预案。胡杨又称“异叶杨”。胡杨的叶片多姿多彩,有柳叶形的,有榆叶形的,有杨叶形的,还有其它叶形的。柳叶类似松柏的针叶,当气候干旱时,柳叶可以减少水分的蒸发,减少根对地下水的提取。杨叶类似植物的阔叶,当胡杨突遇过路的洪流纠缠时,阔叶加大水分蒸发,可以减轻洪涝的伤害。阔叶强劲的光合作用,又可促进胡杨的生长和繁茂。
碱,是许多植物望而生畏的东西,但胡杨不怕碱。人体在排泄垃圾,躲避腥臭,而植物把垃圾当营养,把腥臭当芳香。这世界没有废物。只要是发生的,都是合理的;只要是存在的,都是必要的。每一种物质都有特殊的用途。动物不需要的,植物需要,动物和植物都不需要的,地母需要。许多生命都在逃避碱的伤害,但胡杨不逃避,胡杨选择了融合。你是一把火,我也变成一把火,你就烧不着我了。你是“苦难”,我比你还苦,你就苦不疼我了。胡杨让自己习惯于碱的味道,习惯于碱刺激亢奋的感觉。后来,胡杨决定把碱装在自己身上,那高大的躯干,仿佛一条背袋,胡杨把自己变成背负“苦难”赶路的人。碱被胡杨收缴,碱性就发作不起来了。胡杨把自己变成吸碱的磁石,使那些怕碱的生命得以安然生息。
胡杨带翅膀的种子天生会飞。大漠里的风,助推力极强,胡杨想到多远的地方去,愿望都可以实现,胡杨“跳槽”的能力比谁都强。但胡杨不喜欢“跳槽”,它喜欢“大漠落日”的悲壮,喜欢金沙劲舞的欢姿,喜欢会走动的沙丘神奇的活力,喜欢漠风激越悠扬的长号。当深秋来临,寒霜爬上枝头,胡杨便借助霜的能量铸造一身金币,展现生命的辉煌。有人把胡杨的孩子从荒漠掠走,植入风调雨顺的城市的街区和花园,胡杨在那里长得很茂,身材颀长,肌肤如玉。胡杨也懂养尊处优,但胡杨更习惯于那种“奇怪的甜”,只有那种奇怪的甜才能催生胡杨特有的风骨。
胡杨在坚守。为什么要守住那片不毛之地?因为不毛的土地需要绿色来拯救。需要,就是胡杨的选择。生命升华到一定层面,就变得非常简单了,简单的思想里只有“选择”,无需再问那么多“为什么”了。高尚的生命,高尚到一定高度,就变成了语言的矮子。智慧的生命,智慧高深到一定程度,就不再拥有智慧,智慧化作了单纯。
(节选自2011年第1期《散文百家》)
小题1:如何理解“高尚的生命,高尚到一定高度,就变成了语言的矮子”?请结合文意加以简要的分析。(4分)
小题2:为什么说“胡杨的坚守”,是“智慧地坚守”?(8分)
小题3:文中写胡杨被植入城市的街区和花园,长得茂盛颀长,这样写有何用意?(6分)
小题4:文章第二段说:“许多生命以为,胡杨是浸泡在苦难里的生命,表示莫大的同情和怜悯。”结合全文内容联系现实,谈谈你的看法。(7分)
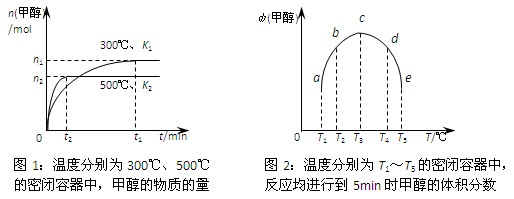
 CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。