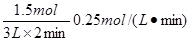(本题共8分)将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g) CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
(1).用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是_____________________。
(2).当改变反应的某一个条件,平衡一定向正反应方向移动的是__________。
a.逆反应速率先增大后减少 b.正反应速率先增大后减少
c.某反应物的体积百分含量减小 d.化学平衡常数K值增大
(3).达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是 (填序号)。
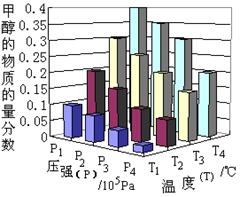
A.P3>P2T3>T2
B.P2>P4T4>T2
C.P1>P3T1>T3
D.P1>P4T2>T3(4).平衡时,测得H2O(g)的物质的量分数为0.30,则用H2O(g)的物质的量浓度变化来表示该反应在2分钟内的平均反应速率为 mol ∙ L-1∙ min-1。
(1).3υ(CO2)正=υ(H2)逆,或3υ(CO2) 逆=υ(H2)正 (2分)
(2).b、d (2分)
(3).C、D (2分)
(4).0.25 (2分)
(1).因为速率之比是相应的化学计量数之比,所以答案是3υ(CO2)正=υ(H2)逆,或3υ(CO2) 逆=υ(H2)正。
(2).只要正反应速率大于逆反应速率,平衡就向正反应方向移动,所以b正确,a不正确。向正反应方向移动,则平衡常数一定增大,d正确。反应物的体积分数减小,平衡也可能向逆反应方向移动,例如通过降低反应物的浓度。答案选bd。
(3)由于反应是体积减小的放热的可逆反应,升高温度平衡向逆反应方向移动,甲醇的含量降低。增大压强平衡向正反应方向移动,甲醇的含量增大。因此选项CD正确,答案选CD。
(4).设生成水蒸气是xmol,则反应后的物质的量是8-2x,所以有(8-2x)×0.3=x,解得x=1.5mol。反应速率通常用单位时间内浓度的变化量来表示,所以水蒸气的反应速率是