(12分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2及固体催化剂,使之反应。已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量 ( )
A.小于92.2 kJ B.等于92.2 kJ C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数 ( )
A.等于0.25 B.大于0.25 C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充入N2的物质的量a mol的取值范围是_________________________________________。
(4)如图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。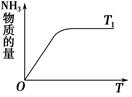
(12分) (1)B 3分 (2)C 3分 (3)1<a≤2 3分
(4)  3分
3分
(1) N2(g)+3H2(g)  2NH3(g)
2NH3(g)
起始量(mol) 2 8 0
转化量(mol) x 3x 2x
平衡量(mol) 2-x 8-3x 2x
所以有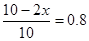 ,解得x=1,所以生成氨气是2mol,则发出热量是92.2 kJ,答案选B。
,解得x=1,所以生成氨气是2mol,则发出热量是92.2 kJ,答案选B。
(2)2 mol NH3、1 mol H2相当于是2mol、4mol氢气。由于反应是体积减小的可逆反应,所以产生相当于在用来的基础上减压,平衡向逆反应方向移动,所以氨气的分数小于0.25,答案选C。
(3)根据(1)可知,平衡时氮气是1mol,所以要使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则氮气的物质的量不需满足1<a≤2。
(4)温度高,反应速率快,达到平衡的时间少。但平衡向逆反应方向移动,所以图像为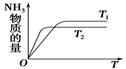 。
。
