(14分)Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
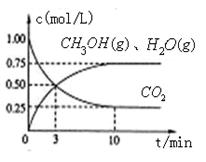
①写出该工业方法制取甲醇的化学反应方程式 。
②从反应开始到平衡,氢气的平均反应速率v (H2)= 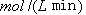 。
。
③该条件下CO2的转化率为 。当温度降低时CO2的转化率变大,则该反应 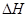 0(填“>”“<”或“=”)。
0(填“>”“<”或“=”)。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度
B.充入氮气
C.将水蒸气从体系中分离
D.用更有效的催化剂(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为 。
Ⅱ.研究NO2 、SO2 、CO等大气污染气体的处理具有重要意义。其中氮元素有着多变价态和种类多的化合物,它们在工农业生产、生活中发挥着重要的作用。完成下列问题:
(1)已知:2SO2(g) + O2(g) 2SO3(g) ΔH=" —196.6" kJ·mol―1
2SO3(g) ΔH=" —196.6" kJ·mol―1
2NO(g) + O2(g) 2NO2(g) ΔH= —113.0 kJ·mol―1
2NO2(g) ΔH= —113.0 kJ·mol―1
则反应NO2(g) + SO2(g) SO3(g) + NO(g) 的ΔH= 。
SO3(g) + NO(g) 的ΔH= 。
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,
①下列能说明反应达到平衡状态的是 (填序号) 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.相同时间内,每消耗1 molNO2的同时消耗1 mol SO3
②当测得上述反应平衡时NO2与SO2体积比为1: 6,则平衡常数K= 。
理科综合试卷·第1页(共16页) |
 CH3OH + H2O(2分)② 0.225 (1分) ③ 75% (1分) < (1分) ④ C(1分)
CH3OH + H2O(2分)② 0.225 (1分) ③ 75% (1分) < (1分) ④ C(1分)(2)CH3OH-6 e- + 8OH- =CO32- + 6H2O(2分)
II.(1)-41.8 kJ·mol-1(2分)(2)①b d(2分) ②8/3或2.67(2分)
I.(1)① 根据反应物和生成物可知,方程式为 CO2 + 3H2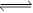 CH3OH + H2O。
CH3OH + H2O。
②平衡时生成甲醇是0.75mol/L,所以根据方程式可知,消耗氢气是0.75mol/L×3=2.25mol/L,因此其反应速率是2.25mol/L÷10min=0.225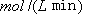 。
。
③根据图像可知,消耗CO2是0.75mol/L,素其转化率是0.75mol/L÷1.0mol/L×100%=75%。温度降低时CO2的转化率变大,说明降低温度平衡向正反应方向移动,所以正反应是放热反应。
④升高温度平衡向逆反应方向移动,n(CH3OH)/n(CO2)降低,A不正确。充入氮气,平衡不移动,B不正确。将水蒸气从体系中分离,相当于降低生成物浓度,平衡向正反应方向移动,n(CH3OH)/n(CO2)增大,C周期。催化剂不能影响平衡状态,D不正确,答案选C。
(2)原电池中负极失去电子,所以甲醇在负极通入。由于电解质溶液显碱性,所以负极电极反应式为CH3OH-6 e- + 8OH- =CO32- + 6H2O
II.(1)考查盖斯定律的应用。(①-②)÷2即得到O2(g) + SO2(g) SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1.
SO3(g) + NO(g),所以反应热是(—196.6 kJ·mol―1+113.0 kJ·mol―1)÷2=-41.8 kJ·mol-1.
(2)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。颜色深浅和浓度有关系,所以b正确。反应前后羰基不变,所以压强也是随着不变的,a不正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以c不正确。d中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。答案选bd。
② NO2(g) + SO2(g) SO3(g) + NO(g)
SO3(g) + NO(g)
起始量(mol) 1 2 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 2-x x x
所以有(1-x)︰(2-x)=1︰6,解得x=0.8,所以平衡常数是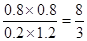 。
。
