(13分)在100℃时,将0.100 mol 的四氧化二氮气体充入 1 L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
从表中分析:c1________c2;c3________c4(填“>”、“<”或“=”)。
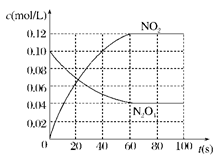
(2)在下图中画出并标明此反应中c(N2O4)和c(NO2)的浓度随时间变化的曲线。

(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__ mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO2气体的浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(13分) (1)K=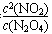 ,< , =
,< , =
(2)
(3)0.001 (4)B
】(1)N2O4  2NO2
2NO2
初n: 0.10 0
20s: 0.07 0.06
40s 0.05 0.10
60s: 0.04 0.12
80s: 0.04 0.12
(3)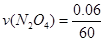 =0.001 mol/(L·s)
=0.001 mol/(L·s)
(4)增大容器的容积,各物质浓度均减少,虽然平衡略向右移,但NO2气体的浓度相对原平衡仍然是减小;而在题设条件下,恒容,分离出一定量的NO2,其浓度减少,虽然平衡略向右移,但NO2气体的浓度相对原平衡仍然是减小;再充入一定量的He,各物质浓度不变,平衡不移动;再充入一定量的N2O4,平衡正向移动,NO2气体的浓度增大,符合题意。
