依据题目要求回答下列问题。
(1)常温下,浓度均为 0.l mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②浓度均为0.0l mol·L-1的下 * * 种物质的溶液中,酸性最强的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)
A. CH3COOH + Na2CO3 = NaHCO3 + CH3COONa
B. CH3COOH + NaCN = CH3COONa + HCN
C. CO2 + H2O + NaClO = NaHCO3 + HClO
D. CO2 + H2O + 2C6H5ONa = Na2CO3 + 2C6H5OH
④要增大氯水中HC1O的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10—20。又知常温下某CuSO4溶液里 c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_ 。
(1)①CO32- ②D;C ③D ④ Cl2+HCO3-=CO2+Cl-+HClO (分步书写参照给分) (2) 5
题目分析:(1)①酸越弱,相应的酸根越容易水解,溶液的碱性越强,则根据盐溶液的pH值可知,结合H+能力最强的是CO32-。
②根据相应盐溶液的pH值可知,酸性由强到弱的顺序是醋酸、碳酸、次氯酸、HCN、苯酚、碳酸氢钠。所以酸性最强的是醋酸,答案选D。将各溶液分别稀释100倍,pH变化最小的是应该是酸性最弱的苯酚,答案选C。
③根据较强酸制备较弱的酸可知,碳酸氢钠不可能制备苯酚,因此选项D是不可能的,生成物应该是苯酚和碳酸氢钠,其余选项都是正确的,答案选D。
④ 由于酸性是盐酸强于碳酸的,碳酸强于次氯酸的,但次氯酸的强于碳酸氢钠的,则向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为Cl2+HCO3-=CO2+Cl-+HClO。
(2)根据氢氧化铜的溶度积常数可知,此时溶液中OH-的浓度=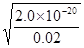 =1×10-9mol/L,则溶液中pH=5。
=1×10-9mol/L,则溶液中pH=5。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,难易适中,注重答题的灵活性,有利于培养学生的逻辑思维能力和抽象思维能力。该题的关键是明确酸性强弱与盐类水解程度的关系以及溶度积常数的含义和应用。
