(11分)
(Ⅰ)有可逆反应A(g) + 3B(g)  2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3 ;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示:
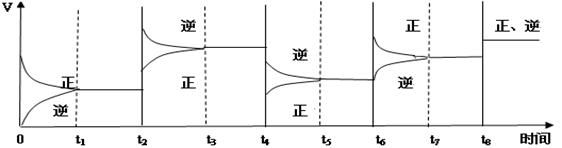
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时______ _____;t6时___ _______;t8时_______ ____。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
若某可逆反应的化学平衡常数表达式为
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.容器中气体的平均相对分子质量不随时间而变化
B.υ正(H2O)=υ逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总的物质的量不随时间而变化E. 消耗n mol H2的同时消耗n mol CO
(1) 减小(1分) (2)增大 增大 (2分)
(3)升高温度 减小压强 增大反应物浓度 使用了催化剂 (4分)
(Ⅱ)(1)(2)
(Ⅰ)(1)反应是放热反应,所以升高温度平衡向逆反应方向移动,平衡常数减小。
(2)增大生成物浓度,正逆反应速率都是增大的。
(3)t2时正逆反应速率都是增大的,但平衡向逆反应方向移动,所以改变的条件是升高温度。t4时正逆反应速率都是减小的,但平衡向逆反应方向移动,所以改变的条件是减小压强;t6时正反应速率增大,逆反应速率不变,平衡向正反应方向移动,所以改变的条件是增大反应物浓度;t8时,正逆反应速率都是增大的,但平衡不移动,所以改变的条件是使用了催化剂,
(Ⅱ)(1)根据平衡常数的表达式可知,方程式为C+H2O(g) H2+CO。
H2+CO。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以B正确。E中反应速率的方向是相同的,不正确。反应前后条件减小,所以压强也是减小的,D正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以C正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是变化的,所以A可以说明。答案选ABCD。