问题
选择题
25℃时,某氯化铵溶液pH=4,下列说法正确的是
A.c(OH¯)=1×10¯10mol·L¯1
B.c(NH4+)>c(Cl¯)>c(H+)>c(OH¯)
C.c(NH3·H2O)=c(NH4+)
D.c(H+)+c(NH4+)=c(Cl¯)+ c(OH¯)
答案
AD
题目分析:pH=4,则氯化铵溶液c(H+)=10-4mol•L-1,由于溶液中c(H+)•c(OH-)=Kw、25℃时Kw =10-14,则该溶液中c(OH-)= 10-10mol•L-1,故A正确;电离程度:NH4Cl>H2O,氯化铵是强酸弱碱盐,铵根离子能在水中部分水解,与水电离出的氢离子反应生成一水合氨,促进水的电离平衡右移,而氯离子不能水解,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B错误;铵根离子的水解程度很弱,则该溶液中c(NH4+)>c(NH3•H2O),故C错误;该溶液中含有四种离子:Cl-、NH4+、H+、OH-,溶液中呈电中性,则c(NH4+)+c(H+)=c(OH-)+c(Cl-),故D正确。

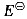 Zn2+|Zn(s)=-0.7630 V、
Zn2+|Zn(s)=-0.7630 V、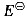 Cl-1|Cl(g)|Pt(s)=1.3580V,若用能斯特方程计算下列原电池的电动势E,其值为()V。Zn(s)|ZnCl2(b=0.02mol·kg-1,γ±=0.6423)|Cl2(0.5
Cl-1|Cl(g)|Pt(s)=1.3580V,若用能斯特方程计算下列原电池的电动势E,其值为()V。Zn(s)|ZnCl2(b=0.02mol·kg-1,γ±=0.6423)|Cl2(0.5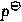 )|Pt(s)
)|Pt(s)