(14分)反应① Fe(s)+CO2(g)===FeO(s)+CO(g);△H1=" a" kJmol-1反应② CO(g)+1/2O2(g)===CO2(g);△H2=" b" kJmol-1测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:

(1)反应①的化学平衡常数表达式为 ,a 0(填“>”、“<”或“=”)。在 500℃2L 密闭容器中进行反应①,Fe 和 CO2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO2的转化率为 ,用CO表示的化学反应速率为 。
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应容器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂(3)由反应①和②可求得反应 2Fe(s)+O2(g)===2FeO(s) △H3中的△H3= (用含a、b的代数式表示)。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“甲醇”或“氧气”),b处电极上发生的电极反应式: 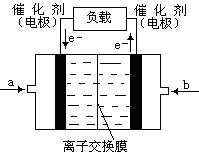
(1)K=c(CO)/c(CO2)(1分) >(1分) 50%(1分) 0.1mol/(L·min-1) (1分)
(2)BC(2分) (3)2(a+b)kJ·mol-1(3分)
(4)氧气(2分) CH3OH - 6e- + 8OH - ="=" CO3 2- + 6H2O (3分)
(1)平衡常数是指在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应式可知,K=c(CO)/c(CO2)。根据表中数据可知,随着温度的升高,K增大,说明升高温度平衡向正反应方向移动,说明正反应是吸热反应。设平衡时CO2的转化率为x,则生成CO设4x,剩余CO2是(4-4x),所以根据平衡常数的表达式可知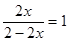 ,解得x=0.5,即转化率是50%。生成CO的浓度是4mol×0.5÷2L=1mol/L,所以反应速率是1mol/L÷10min=0.1mol/(L·min-1)。
,解得x=0.5,即转化率是50%。生成CO的浓度是4mol×0.5÷2L=1mol/L,所以反应速率是1mol/L÷10min=0.1mol/(L·min-1)。
(2)由于反应是体积不变的、吸热的可逆反应。所以改变压强平衡不移动,催化剂只能改变反应速率,而不能影响平衡状态,AD不正确。增大反应物浓度或升高温度,平衡都向正反应方向移动,答案选BC。
(3)考查盖斯定律都应用。根据已知反应(①+②)×2即得到2Fe(s)+O2(g)===2FeO(s),所以反应热是2(a+b)kJ·mol-1。
(4)原电池中负极失去电子,正极得到电子,根据电子都流向可知右侧是负极,左侧是正极,所以b处通入甲醇,a处通入氧气。由于电解质是氢氧化钾,所以负极反应式为CH3OH - 6e- + 8OH - ="=" CO3 2- + 6H2O。
