问题
选择题
把3.0mol M和2.5mol N混合于2.0L的恒容密闭容器中,发生反应
3M (g) + N (g)  xP (g) +2Q (g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol·L-1·min-1,则下列说法正确的是()
xP (g) +2Q (g),5min反应达到平衡,已知M的转化率为50%,P的反应速率为0.15mol·L-1·min-1,则下列说法正确的是()
A.方程式中x=2
B.达平衡后,容器内压强是反应起始时的2倍
C.向容器中再充入3.0molM和2.5molN,达新平衡时Q 的体积分数减小
D.容器内混合气体的密度不再变化和平均相对分子质量不再变化均可作为达到平衡状态的标志
答案
答案:C
P的反应速率为0.15mol·L-1·min-1,则生成P是0.15mol·L-1·min-1×2L×5min=1.5mol。M的转化率为50%,则消耗M是1.5mol,所以x=3,A不正确。平衡时MNPQ的物质的量分别是1.5mol、2.0mol、1.5mol、1.0mol,所以达平衡后,容器内压强是反应起始时的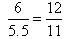 ,B不正确。向容器中再充入3.0molM和2.5molN,相当于增大压强,破坏向逆反应方向移动,所以Q 的体积分数减小,C正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以选项D不正确。答案选C。
,B不正确。向容器中再充入3.0molM和2.5molN,相当于增大压强,破坏向逆反应方向移动,所以Q 的体积分数减小,C正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以选项D不正确。答案选C。