100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,将pH=8的Ba(OH)2溶液V1L与pH=5,V2 L NaHSO4混合(忽略溶液体积变化),所得溶液pH=7,则V1:V2=( )
A.1:9
B.1:1
C.2:9
D.1:2
答案:C
题目分析:硫酸氢钠溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.01mol·L-1 NaHSO4溶液中C(H+)=0.01mol·L-1,水电离的c(H+)=c(OH-)=10-10 mol·L-1,所以Kw=10-12;该温度下,氢氧化钡溶液中c(OH-)=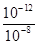 mol·L-1=10-4 mol·L-1,混合溶液呈碱性,溶液中c(OH-)=
mol·L-1=10-4 mol·L-1,混合溶液呈碱性,溶液中c(OH-)=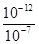 mol·L-1=10-5 mol·L-1,
mol·L-1=10-5 mol·L-1,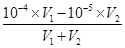 =10-5,所以V1:V2=2:9,选C.
=10-5,所以V1:V2=2:9,选C.
