(6分)PCl5的热分解反应如下:PCl5(g) 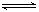 PCl3(g) + Cl2(g)。
PCl3(g) + Cl2(g)。
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。求该温度下的平衡常数。
(3)在相同的容器中起始充入5.00mol PCl5,达平衡后, PCl5的分解率是多少?
(1)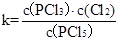 (2)K=0.45 (3)60%
(2)K=0.45 (3)60%
(1)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度幂之积的比值,所以表达式为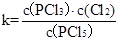 。
。
(2) PCl5(g) 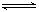 PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
起始浓度(mol/lL) 0.2 0 0
转化浓度(mol/l) 0.15 0.15 0.15
平衡浓度(mol/L0 0.05 0.15 0.15
所以K=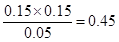
(3) PCl5(g) 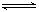 PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
起始浓度(mol/lL) 0.5 0 0
转化浓度(mol/l) x x x
平衡浓度(mol/L0 0.5-x x x
所以K=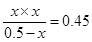
解得x=0.3
所以转化率是0.3÷0.5×100%=60%
