(10分)已知NO2转化为N2O4的反应是放热反应且是可逆反应:2NO2 (g) N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。
N2O4(g)。如下图1所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲、乙分别盛放100mL冷水和热水。
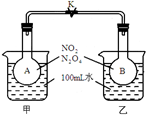
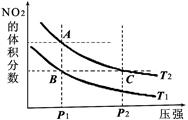
图1 图2
(1)图1中___________瓶中气体颜色更深?(填“A”或“B”)。请比较平衡时反应速率:A瓶__________B瓶;(填“>”“<”或“=”)
(2)在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如上图2所示。请比较图2中A、B两点混合气体的平均相对分子质量:A点_________B点。(填“>”“<”或“="”" )
(3)平衡常数定义为一定条件下,可逆反应平衡时产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积比。即aA(g)+bB(g)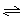 pC(g)+qD(g)中K=
pC(g)+qD(g)中K= 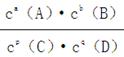
下如:N2(g)+3H2(g)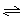 2NH3(g)的平衡常数表示式K=
2NH3(g)的平衡常数表示式K=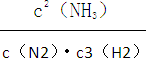
①2NO2 (g) N2O4(g)的平衡常数表达式K=
N2O4(g)的平衡常数表达式K=
②平衡常数K的具体值会随温度而改变。请比较上图2中A点和B点所对应的平衡常数数值。A点____________B点(填“>”“<”或“=”)。
(1)B < (2)< (3)① ②<
②<
(1)由于反应是放热反应,所以温度低有利于平衡向正反应方向移动,即甲中颜色更深。乙中温度高,反应速率大。
(2)在压强相同是,温度为T2的NO2体积分数大,说明温度是T2大于T1,即A点气体的物质的量多,因此A点混合气的平均相对分子质量小。
(3)①根据平衡常数的概念可知,该反应的平衡常数表达式为K= 。
。
②由于温度是T2大于T1,而温度低有利于平衡向正反应方向移动,所以B点平衡常数大。
