(10分).在200℃时,将a mol H2(g)和b mol Br2(g)充入到体积为1 L的密闭容器中,发生反应:Br2(g)+H2(g)  2HBr(g)。
2HBr(g)。
(1)反应刚开始时,由于c(H2)=________________,而c(HBr)=______,所以v正最大,而v逆最小为零;
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(Br2)______,
而c(HBr)__________,从而化学反应速率v正____________,而v逆________;(填“增大”、“减小”或“不变”)
(3)当反应进行到v正与v逆________时,此可逆反应就达到了平衡,若保持外界条件不变时,反应混合物中各组分百分含量都将________。
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),反应速率_______(填“增大”、“减小”或“不变”)理由是_______________
a mol/L 0 减少 增大 减小 增大 相等 不变 不变 反应物浓度没有变化
(1)在反应开始时,氢气的浓度是a mol/L ,而溴化氢的浓度是0,所以所以v正最大,而v逆最小为零。
(2)随着反应的进行,反应物的浓度逐渐减小,生成物的浓度逐渐增大,所以正反应速率逐渐减小,逆反应速率逐渐增大。
(2)当正逆反应速率相等时,可逆反应就达到了平衡,若保持外界条件不变时,反应混合物中各组分百分含量都将不再发生变化。
(4)由于压强是不变的,所以再加入a mol H2(g)和b mol Br2(g)时,浓度是不变的,反应速率是不变的,平衡是等效的。

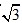 A
A /2
/2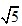 /2A
/2A