问题
填空题
5000C下发生如下反应H2(g)+CO2(g)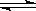 H2O(g)+CO(g)△H<0,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。(已知此温度下该反应的平衡常数K=
H2O(g)+CO(g)△H<0,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。(已知此温度下该反应的平衡常数K=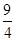 )
)
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
在甲、乙、丙三个恒容密闭容器中CO2转化率大小比较
(2).丙中达平衡需要20S,则反应速率V(CO2)=
(3).甲中的反应速率-时间图像如图,在图中画出丙的反应速率-时间图像

(4)升高温度,平衡常数K  (填 “大于”“小于”“等于”)
(填 “大于”“小于”“等于”)
答案
60% 乙>丙=甲 0.0006mol/(L·S) 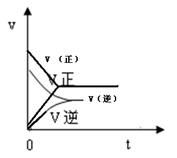 小于
小于
(1)设CO2的转化率是x,则生成水蒸气和CO都是0.010xmol/L,所以根据平衡常数表达式可知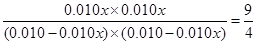 ,解得x=0.6,即转化率是60%;由于反应前后体积不变,所以甲和丙中平衡是等效的,转化率相同。乙相当于在甲的基础上增加氢气的浓度,因此提高CO2的转化率,即甲、乙、丙三个恒容密闭容器中CO2转化率大小是乙>丙=甲。
,解得x=0.6,即转化率是60%;由于反应前后体积不变,所以甲和丙中平衡是等效的,转化率相同。乙相当于在甲的基础上增加氢气的浓度,因此提高CO2的转化率,即甲、乙、丙三个恒容密闭容器中CO2转化率大小是乙>丙=甲。
(2)丙中平衡时消耗CO2是0.0120mol/L,所以反应速率是0.0120mol/L÷20s=0.0006mol/(L·S)。
(3)丙中反应物浓度大,达到平衡的时间少,所以图像是(见答案)
(4)由于正反应是放热反应,所以升高温度,平衡向逆反应方向移动,平衡常数减小。
