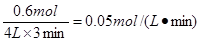问题
计算题
(6分)在4L的密闭容器中,充入1molN2和4molH2,在一定条件下反应,3分钟后达到平衡状态,相同温度下,测得平衡时气体的压强比反应前混合气体的压强减少了12%,则
(1)平衡时混合气体中三种气体的物质的量之比为 。
(2)N2的转化率为 。
(3)3分钟内NH3的平均反应速率为 。
答案
(1)7:31:6 (2)30% (3)0.05 mol/(L·min)(每空2分)
考查可逆反应的有关计算,一般采用三段式。
N2+3H2 2NH3.
2NH3.
起始量(mol) 1 4 0
转化量(mol) x 3x 2x
平衡量(mol) 1-x 4-3x 2x
所以有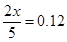
解得x=0.30mol
(1)因此平衡时混合气体中三种气体的物质的量之比为0.70︰3.1︰0.6=7:31:6
(2)N2的转化率为x÷1×100%=30%
(3)3分钟内NH3的平均反应速率为