(14分)T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
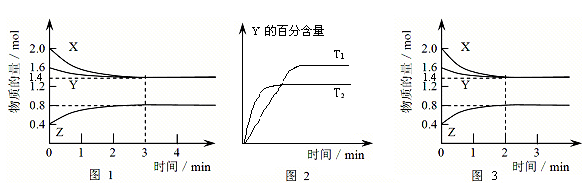
(1)容器中发生的反应可表示为______ ________ ________ __
(2)该反应的△H 0(填“>”、“<”或“=”)
判断理由是:______ ________ ________ ________ ____ ________ __。
(3)反应进行的前3 min内,用X表示的反应速率 v(X)=____________
(4)保持其他条件不变,升高温度,该反应的化学平衡常数K将____________(填“变大”、“减小”或“不变”)
(5)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.增加X的浓度 d.增加气体Y的浓度
(1)3X(g)+ Y (g)  2Z(g) (2分)(2)> (2分)根据图2得出:T2>T1 升高温度Y的百分含量降低平衡正向移动。(2分)
2Z(g) (2分)(2)> (2分)根据图2得出:T2>T1 升高温度Y的百分含量降低平衡正向移动。(2分)
(3)0.1 mol/(L∙ min) (2分) (4)变大(2分)
(5)①加入催化剂 (2分) ② a c (2分)
(1)根据特异性1可知,XY的物质的量分别减少了2.0mol-1.4mol=0.6mol、1.6mol-1.4mol=0.2mol。Z的物质的量增加了0.8mol-0.4mol=0.4mol。所以根据变化量之比是相应的化学计量数之比可知,方程式为3X(g)+Y (g)  2Z(g)。
2Z(g)。
(2)根据图像2可知,T1小于T2,温度高,Y的含量低,说明升高温度平衡向正反应方向移动,所以正反应是吸热反应,即△H大于0.
(3)反应进行的前3 min内,用X表示的反应速率 v(X)=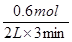 =0.1 mol/(L∙ min)。
=0.1 mol/(L∙ min)。
(4)保持其他条件不变,升高温度,平衡平衡向正反应方向移动,平衡常数增大。
(5)①根据图像3可知,平衡状态没有改变,说明改变的条件是加入了催化剂。
②因为正反应是体积减小的、吸热的可逆反应,所以升高温度或增大压强,平衡都向正反应方向移动,转化率增大,a正确。催化剂不能改变平衡状态,b不正确。增加X的浓度,平衡向正反应方向移动,Y的转化量增大,c正确。增加Y的浓度,平衡向正反应方向移动,但Y的转化率降低d不正确,答案选ac。
