问题
计算题
已知反应:FeO(s)+CO(g)= Fe(s)+CO2(g)的Kc=0.5(1273K)。若起始浓度c(CO)=0.05 mol/L,c(CO2)=0.01 mol·L-1,请回答:
(1)计算CO 和CO2平衡浓度。
(2)CO的转化率是多少?
(3)增加FeO的量,对平衡有无影响?
答案
(1)反应将向右进行,CO和CO2的平衡浓度分别为0.04 mol·L-1、0.02 mol·L-1; (2)CO的转换率20%; (3)没有影响
(1)考查可逆反应的有关计算,一般采用三段式,即
FeO(s)+CO(g)= Fe(s)+CO2(g)
起始浓度(mol/L) 0.05 0.01
转化浓度(mol/L) x x
平衡浓度(mol/L) 0.05-x 0.01+x
所以有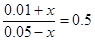
解得x=0.01mol/L
所以CO和CO2的平衡浓度分别为0.04 mol·L-1、0.02 mol·L-1。
(2)CO的转化率是0.01÷0.05×100%=20%
(3)氧化亚铁是固体,增加FeO的量,对平衡无影响。
