问题
填空题
(6分)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
⑵若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
⑶生产过程中,合成气要进行循环,其目的是 。
答案
⑴ > ⑵ 0.03 mol·L-1·min-1 ⑶ 提高原料CO、H2的利用率(或提高产量、产率亦可)。
(1)根据物质的浓度可知,此时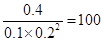 <160,所以反应向正反应方向进行,即正反应速率大于逆反应速率。
<160,所以反应向正反应方向进行,即正反应速率大于逆反应速率。
(2)根据(1)可知,起始时氢气的浓度是1.0mol/L,所以在(2)中氢气的浓度变化量是0.6mol/L,则生成甲醇是0.3mol/L,则甲醇的反应速率是0.3mol/L÷10min=0.03 mol·L-1·min-1。
(3)生产过程中,合成气进行循环,可以提高原料CO、H2的利用率。
