(共8分)
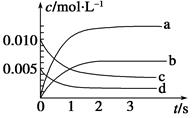
在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)求 2 s末用氧气表示的平均反应速率v(O2)=
(3)求达平衡时NO的转化率为
(4)能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.增大O2的浓度
(1)b (2) 1.5×10-3mol·L-1·s-1(3)65% (4)b、c (5)b
(1)由表格所给数据知道平衡时△n(NO)=0.013mol,同时由化学方程式得出△n(NO2)=0.013mol,其浓度为0.0065 mol·L-1,故图中表示NO2的变化的曲线是b;
(2)υ (NO)= 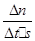 =1.5×10-3mol·L-1·s-1
=1.5×10-3mol·L-1·s-1
(3)α(NO)=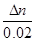 =65%
=65%
(4)本反应是一个气体系数变化的反应,所以在恒容情况下,容器内的密度是定值,不能做为平衡的判定标准。而总物质的量、总压强是个变量,可做为判定标志。而a没有说明正逆反应速率的关系,排除,c可推出正逆速率相等。
(5)及时分离出NO2气体虽然可使平衡正向移动,但浓度降低,反应速率减小,不符合题意。
