问题
选择题
改变下列条件,不能使水的电离程度增大的是
A.加热
B.加入少量的盐酸
C.加入少量的Na2CO3固体
D.加入少量的NH4Cl晶体
答案
答案:B
题目分析:A.水的电离H2O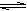 H++OH-是吸热的,升高温度,水的电离平衡向电离的方向移动,水的电离程度增大。错误。B.加入少量的盐酸时,即增大了H2O
H++OH-是吸热的,升高温度,水的电离平衡向电离的方向移动,水的电离程度增大。错误。B.加入少量的盐酸时,即增大了H2O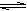 H++OH-的生成物的浓度,根据平衡移动原理,增大生成物的浓度,平衡向逆反应方向即抑制水电离的方向移动。符合题意,正确。C.加入少量的Na2CO3固体时消耗了H2O
H++OH-的生成物的浓度,根据平衡移动原理,增大生成物的浓度,平衡向逆反应方向即抑制水电离的方向移动。符合题意,正确。C.加入少量的Na2CO3固体时消耗了H2O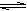 H++OH-水电离产生的H+,使水电离产生的H+的浓度减小,电离平衡正向移动,最后使水的电离程度增大。不符合题意。错误。D。NH4+会和水电离产生的OH-离子结合产生弱电解质NH3·H2O,破坏了水的电离平衡,水继续电离,最终导致水的电离程度增大,与题干不符合。错误。
H++OH-水电离产生的H+,使水电离产生的H+的浓度减小,电离平衡正向移动,最后使水的电离程度增大。不符合题意。错误。D。NH4+会和水电离产生的OH-离子结合产生弱电解质NH3·H2O,破坏了水的电离平衡,水继续电离,最终导致水的电离程度增大,与题干不符合。错误。
