(10分)在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
(1)CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=________mol/(L·min).t1℃时物质浓度(mol/L)的变化
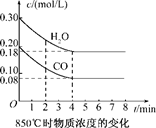
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3 min~4 min 之间反应处于________状态;c1________0.08 mol/L(填“>”“<”或“=”).
②反应在4 min~5 min间,平衡向逆方向移动,可能的原因是________(单选),表中5 min~6 min之间数值发生变化,可能的原因是________(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(1)0.03 (2)①平衡 > ②d a
(1)v(CO)=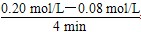 =0.03 mol/(L·min).
=0.03 mol/(L·min).
(2)①0 min~2 min, c(CO)减小 0.062 mol/L,即平均速率为0.031 mol/(L·min),由于反应速率一般随反应的进行而减慢,所以2 min~3 min, c(CO)的减小值小于0.31 mol/L,因此c1>(0.138-0.031) mol/L>0.08 mol/L;
②由于降低温度平衡向右移动,所以4 min~5 min的条件变化不是b,由于c(CO2)减小,应是增加了H2浓度;第5 min~6 min, c(CO)减小,c(H2O)增大,c(CO2)增大,应是增加了水蒸气.
