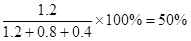已知2SO2(g)+ O2(g) 2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
2SO3(g) △H<0 ,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2, 2min反应达平衡时,容器中有1.2 mol SO3,放出热量117.6 kJ,试计算:
(1)写出该反应的热化学方程式。
(2)该反应中SO2的转化率是多少?
(3)其他条件相同,若起始时改为充入2 mol SO3,,计算达平衡后SO3的质量分数为多少?
(6分,每空2分)
(1)2SO2(g)+ O2(g) 2SO3(g) △H=-196 kJ/mol(计量系数和焓变值对应也行)
2SO3(g) △H=-196 kJ/mol(计量系数和焓变值对应也行)
(2) 60%
(3)50%
考查热化学方程式的书写,可逆反应的有关计算,一般采用三段式。
2SO2(g)+ O2(g) 2SO3(g)
2SO3(g)
起始量(mol) 2 1 0
转化量(mol) 2x x 2x+
平衡量(mol) 2-2x 1-x 2x
所以有2x=1.2mol
解得x=0.6mol
(1)因此如果消耗1mol氧气放出的热量是117.6 kJ÷0.6=196 kJ/mol
所以反应的热化学方程式是2SO2(g)+ O2(g) 2SO3(g) △H=-196 kJ/mol
2SO3(g) △H=-196 kJ/mol
(2)反应中SO2的转化率是2x÷2=0.6,即60%
(3)若起始时改为充入2 mol SO3,则平衡是等效的,因此平衡后SO3的质量分数为