已知元素M是组成物质NH4Al(SO4)2的一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如下表所示:
| I1 | I2 | I3 | I4 | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 |
(1)元素M的名称是_______________;
(2)硫原子核外有______种不同运动状态的电子,有______种不同形状的电子云;
(3)请用一个事实证明氧气的氧化性比硫的氧化性强:______________________________。
(4)相同条件下,0.1 mol/L NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol/LNH4HSO4中c(NH4+)。
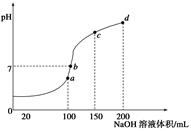
(5)室温时,向100 mL 0.1 mol/LNH4HSO4溶液中滴加0.1 mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是____________;
②在b点,溶液中各离子浓度由大到小的排列顺序是________;
③在c d段发生反应的离子方程式_________________。
(1)铝 ;
(2)16 、2
(3)2H2S + O2 = 2H2O+2S↓
(4)小于
(5)①a; ②c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) ③NH4+ + OH-=NH3·H2O;
题目分析:(1)由于该元素的第一、第二、第三电离能相差不多,但第四电离能与第三电离能相差很多,说明该元素的原子最外层有三个电子。在组成的NH4Al(SO4)2的元素中只有Al符合题意。因此元素M的名称是铝。
(2)S是16号元素,所以硫原子核外有16种不同运动状态的电子,S的核外电子排布为1s22s22p63s23p4有s、p两种不同形状的电子云;
(3)证明氧气的氧化性比硫的氧化性强的事实是2H2S + O2 = 2H2O+2S↓。
(4)在相同条件下,等浓度的0.1 mol/L NH4Al(SO4)2和0.1 mol/LNH4HSO4中Al3+水解使溶液显酸性比酸电离出的H+酸性要小的多,它们都对(NH4+的水解起到抑制作用。由于后者酸性强,抑制作用大,故c(NH4+)前者小于后者。
(5)①a点对应的NaOH溶液与NH4HSO4的物质的量相等,发生反应NaOH+NH4HSO4= NH4NaSO4 +H2O。NH4++H2O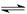 NH3·H2O+H+.对水的电离起到了促进作用。b点时n(NaOH)>n(NH4HSO4)溶液的PH=7,溶液.对水的电离无影响。C点D点对应的NaOH溶液体积逐渐增大,碱越来越多对水的抑制作用越来越强。故水的电离程度最大的是a点。
NH3·H2O+H+.对水的电离起到了促进作用。b点时n(NaOH)>n(NH4HSO4)溶液的PH=7,溶液.对水的电离无影响。C点D点对应的NaOH溶液体积逐渐增大,碱越来越多对水的抑制作用越来越强。故水的电离程度最大的是a点。
②n(NaOH)>n(NH4HSO4)溶液的PH="7," 溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
③在c d段由于OH-过量,所以发生反应的离子方程式NH4+ + OH-=NH3·H2O。4Al(SO4)2的元素的原子结构、性质及与NaOH溶液混合发生反应的离子浓度、方程式等知识。

