现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,一水合氨的电离平衡________(填“向左”、“向右”或“不”)移动;此时溶液中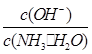 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入等浓度稀醋酸,使其恰好中和,写出反应的离子方程式:_________________;所得溶液的pH________7(填“>”、“<”或“=”),
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时[NH4+]=a mol·L-1,则c(SO42-)=________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________________________________________。
(1)向左 减小 (2)NH3·H2O+CH3COOH=CH3COO-+NH4++H2O = (3)
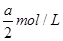
(4)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
题目分析:(1)向氨水中加入少量硫酸铵固体,硫酸铵电离出来的铵根离子会抑制一水合氨的电离,平衡向左移动,此时溶液中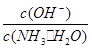 减小 (2)NH3·H2O+CH3COOH=CH3COO-+NH4++H2O ;因为恰好中和,溶液显中性,所得溶液的pH=7 (3)依据电荷守恒有:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),又因为溶液的pH=7,因此有:c(SO42-)=
减小 (2)NH3·H2O+CH3COOH=CH3COO-+NH4++H2O ;因为恰好中和,溶液显中性,所得溶液的pH=7 (3)依据电荷守恒有:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),又因为溶液的pH=7,因此有:c(SO42-)=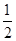 c(NH4+)=
c(NH4+)=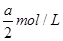 ;(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则得到的是硫酸铵的溶液,因为氨根离子的水解,使得溶液显酸性,因此有如下关系:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
;(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则得到的是硫酸铵的溶液,因为氨根离子的水解,使得溶液显酸性,因此有如下关系:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
