(6分)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g) H2(g)+I2(g),H2物质的量随时间的变化如图所示。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。
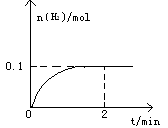
(1) 0—2 min内的平均反应速率v(HI)= 。
该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
0.1 mol/(L·min) 80 b (每空2分)
(1)根据图像可知,0—2 min内,氢气的的物质的量增加了0.1mol,则必然消耗HI是0.2mol,使用平均反应速率v(HI)=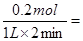 0.1 mol/(L·min) ;平衡时氢气和碘的浓度都是0.1mol/L,而碘化氢的是0.8mol/L,使用该温度下平衡常数K=
0.1 mol/(L·min) ;平衡时氢气和碘的浓度都是0.1mol/L,而碘化氢的是0.8mol/L,使用该温度下平衡常数K=
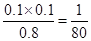 ,所以逆反应的平衡常数是80。
,所以逆反应的平衡常数是80。
(2)平衡常数只与温度有关系,选项a不正确。由于反应前后体积不变,所以该反应是等效的,因此选项b正确,d不正确;浓度增加,反应时间增大,达到平衡的时间减少,选项c不正确,答案选b。
