问题
实验题
实验测定酸碱中和滴定曲线是高中化学的重要定量实验。下表是用0.10 mol/L的盐酸滴定 0.10 mol/L 20.00 mL NaOH 溶液时获得的一些相关数据。请回答下列问题:
(1)填写表中①②对应的 pH (结果保留两位小数)

(2)下图是本实验的滴定曲线图。请根据该图,说明强酸溶液滴定强碱溶液时,为什么既可以使用甲基橙作为指示剂,又可以使用酚酞试液作指示剂来指示滴定终点?
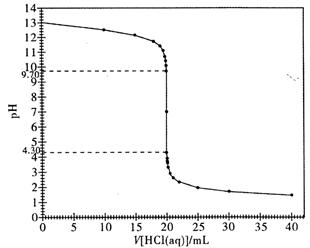
(3)若在滴定终点时俯视读数,最终测得的氢氧化钠溶液的浓度会 (填“偏大”、“偏小”或“没有影响”,下同);若滴定结束时,滴定管尖嘴悬有半滴标准盐酸,最终测得的氢氧化钠溶液的浓度会;若盛装待测液的锥形瓶洗涤干净后,未干燥即盛装待测液,最终测得的氢氧化钠溶液的浓度会 。
答案
(1)①13.00 ②7.00 (2)因为甲基橙和酚酞的变色范围均与滴定曲线中的突跃范围有重叠
(3)偏小 偏大 没有影响。
题目分析:结合NaOH的初始浓度确定其p H为13.00,当滴加盐酸至20.00m L时恰好完全反应,溶液的p H 为7.00;而滴定过程中的误差分析则取决于盐酸的加入量。
