问题
计算题
(10分)在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应达到平衡后测得c(H2)=0.008mol/L。求:(1)该反应的平衡常数。
(2)在同样的温度下,该容器中若通入H2和I2(g)各0.20mol,试求达到平衡状态时H2的转化率
答案
(1)K=1/4 (2)α(H2)=20%
考查可逆反应的有关计算。
(1)根据反应的方程式可知
H2(g)+I2(g) 2HI(g)
2HI(g)
起始量(mol) 0.1 0.1 0
转化量(mol) x x 2x
平衡量(mol) 0.08 0.10-x 2x
所以有 0.10-x=0.08
解得x=0.02mol
所以平衡时氢气、碘和碘化氢的浓度分别是0.008mol/L、0.008mol/L、0.004mol/L
因此平衡常数K=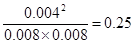
(2)由于反应前后体积不变,所以容器中若通入H2和I2(g)各0.20mol,平衡还是等效的,因此达到平衡状态时H2的转化率不变,仍然是0.02÷0.1=0.2,即20%。
