在容积为1L的密闭容器中,进行如下反应:
A(g)+2B(g)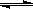 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
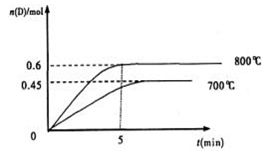
(1)800℃时。0—5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变
B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K= ,该反应为 反应(填吸热或放热)
(4)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
(1)0.24mol·L—1·min—1
(2)AB(2分,漏一个扣1分,错选不得分)
(3)0.9(mol·L—1)—1(单位可不写)吸热
(4)向正反应方向
(1)800℃时。0—5min内,生成D是0.6mol,则消耗B是1.2mol,所以B的反应速率是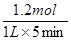 =0.24mol·L—1·min—1。
=0.24mol·L—1·min—1。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以B正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系D不正确;反应过程中压强是变化的,所以当压强不再发生变化时,可以说明,A正确;C中反应速率的方向相反,但不能满足相应的化学计量数之比,所以不正确,答案选AB。
(3)平衡时A、B、C、D的浓度分别是(mol/L)0.4、1.0、0.6、0.6,所以反应的平衡常数是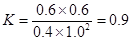 ;根据图像可知,升高温度,D的含量增加,说明正反应一定是吸热反应。
;根据图像可知,升高温度,D的含量增加,说明正反应一定是吸热反应。
(4)在700℃平衡时A、B、C、D的浓度分别是(mol/L)0.55、1.3、0.45、0.45,所以反应的平衡常数是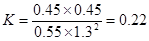 ;由于此时
;由于此时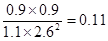 <0.22,所以向正反应方向进行。
<0.22,所以向正反应方向进行。
