(10分)请回答下列问题:
(1)等温、等容下,已知2NO+O2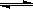 2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。
2NO2 △H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是 (填字母)。
A.升高温度
B.降低温度
C.加入O2
D.减小压强E.加入催化剂 F.增加NO的量
(2)若将l.00 molO2和2.00 mol NO混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用O2表示的化学反应速率为 mol•L-1•min-1。
(3)容积均为2 L的四个密闭容器中均进行着(2)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(O2) | n(NO) | n (NO2) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②v正___v逆? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③v正___v逆? |
填写表中空格: ② ③ (填>或 <)
(10分)(1) B、C、(2)0.075(3) ①40 ②< ③ >
(1)考查外界条件对平衡的影响。正反应是体积减小的、放热的可逆反应,所以降低温度或增大压强或增大氧气的浓度,平衡都向正反应方向进行,NO的转化率都是增大的。催化剂不能改变平衡状态,转化率不变。增加NO浓度,平衡向正反应方向进行,但NO的转化率降低,所以答案选BC。
(2)设消耗氧气的物质的量是x,则消耗NO是2x,生成NO2是2x,则1-x+2-2x+2x=2.55,解得x=0.45,所以用O2表示的化学反应速率为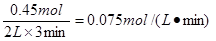 。
。
(3)正逆反应速率相等时即达到平衡状态,所以根据容器I可知,该温度下的平衡常数K=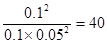 ;容器Ⅱ中此时
;容器Ⅱ中此时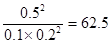 ,所以反应向逆反应方向进行,则正反应速率小于逆反应速率;同样可知容器Ⅲ中此时
,所以反应向逆反应方向进行,则正反应速率小于逆反应速率;同样可知容器Ⅲ中此时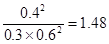 ,所以反应向正反应方向进行,则正反应速率大于逆反应速率。
,所以反应向正反应方向进行,则正反应速率大于逆反应速率。
