(10分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
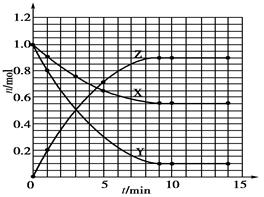
1根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
2体系中发生反应的化学方程式是_____________;
3列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
4该反应达到平衡时反应物X的转化率α等于________;
5如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件温度、压强、催化剂得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3如上右图所示则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。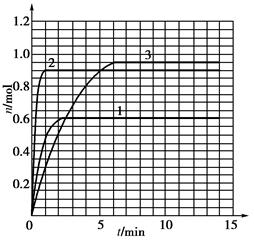
(1) (2)X+2Y
(2)X+2Y 2Z
2Z
(3)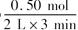 =0.083 mol·L-1·min-1 (4)45% (5)升高温度 加入催化剂 增大压强
=0.083 mol·L-1·min-1 (4)45% (5)升高温度 加入催化剂 增大压强
题目分析: (1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解
 aX + bY
aX + bY cZ
cZ
 开始 1.00 1.00 0
开始 1.00 1.00 0
 转化 0.45 0.9 0.9
转化 0.45 0.9 0.9
 平衡 0.55 0.1 0.9
平衡 0.55 0.1 0.9
 根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y
根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y 2Z。
2Z。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol,其平均速率为
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol,其平均速率为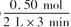 =0.083mol/L·min。
=0.083mol/L·min。
 (4)X的转化率等于
(4)X的转化率等于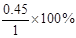 =0.45。
=0.45。
 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
点评:本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
