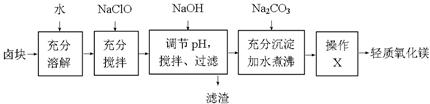
现有甲、乙两个实验,进行反应N2(g)+3H2(g)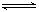 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g) 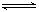 2HI(g) ∆H=-akJ•mol—1,实验条件和起始投料如下表所示,以下结论正确的是
2HI(g) ∆H=-akJ•mol—1,实验条件和起始投料如下表所示,以下结论正确的是

A.甲组中,若平衡时N2和NN3的转化率分别为α1 和α2,则α1 +α2=1
B.乙组中,平衡Ⅱ中NH3的浓度是平衡Ⅰ的二倍
C.丙组中,若达平衡时Ⅰ中放热Q1kJ, Ⅱ中吸热Q2kJ,则Q1+Q2=a
D.丁组中,达平衡所需时间:Ⅰ小于Ⅱ
答案:C
甲是保持恒温恒容的,因为4mol氨气相当于是2mol氮气和6mol氢气,所以甲中I与Ⅱ的平衡是不等效的,则α1 +α2不等于1,A不正确;乙组中,压强和温度不变,所以平衡是等效的,所以平衡Ⅱ中NH3的浓度和平衡Ⅰ中NH3的浓度相等,B不正确;丙中2molHI相当于是1mol氢气和1mol碘,因此平衡是等效的,所以C正确;丁组中,压强和温度不变,因此容器的容积是变化的,则反应物的浓度是相同的,达平衡所需时间相同,所以正确的答案选C。