某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到加入一滴盐酸后,溶液颜色由黄色变为橙色,并 为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的是 。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束后俯视读数(3)某学生根据3次实验分别记录有关数据如表:
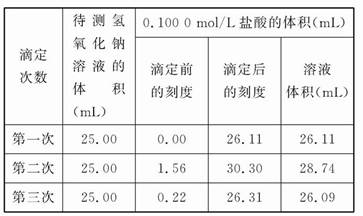
依据上表数据列式计算该氢氧化钠溶液的物质的量浓度为 。
(1)锥形瓶中溶液颜色的变化 30秒内颜色不变 (2)D (3)0.104 4 mol/L
(1)眼睛观察的是锥形瓶内指示剂颜色的变化,而不是滴定管中液体的体积变化;判断滴定终点时,注意在指示剂颜色发生变化后,半分钟内不再复原。
(2)A项,由于未用标准液润洗,导致消耗盐酸的体积比实际上要大,故测定的氢氧化钠溶液的浓度偏高。B项,无影响;C项,这种影响直接导致读数比实际值偏大,故使测定的氢氧化钠溶液的浓度偏高;D项,这种做法导致读数比实际上偏小,故使测定的氢氧化钠溶液的浓度偏低。
(3)28.74应舍去,故取第一、三次盐酸体积的平均值:V="(26.11+26.09)/2=" 26.10(mL),其浓度为0.100 0 mol/L,待测氢氧化钠溶液的体积为25.00 mL,将三者数值代入公式中求解,则该氢氧化钠溶液的物质的量浓度c(NaOH)=c(盐酸)×V(盐酸) /V(NaOH)="0.104" 4 mol/L
