在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物 质 | A | B | C |
| 初始浓度/mol·L-1 | 1.0 | 2.0 | 0 |
| 2min时,平衡浓度/mol·L-1 | 0.4 | 0.2 | 1.2 |
(1)该反应方程式可表示为 ;反应达平衡时,A的转化率为 。
(2)从反应开始到达化学平衡,反应物A的平均反应速率为 ;25℃时,反应的化学平衡常数K值为_____________。
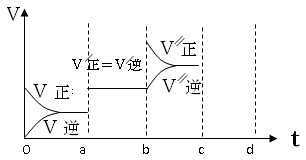
(3)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 。
(4)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号):
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
(每空2分,共14分)
(1)A(g) + 3B(g) 2C(g) (2分) 60%(2分)
2C(g) (2分) 60%(2分)
(2)0.3 mol/(L﹒min) (2分) 4.5×102 或450·L2·mol-2(2分)
(3)加入催化剂(2分) 增加A或B(或反应物的浓度,2分)[说明:增大压强和升高温度v(正) 、v(逆)都会瞬间增大,v″(逆)不能与平衡时v′(逆)的相连]
(4)②④ (2分,选1个且正确1分;错1个0分)
(1)根据表中数据可知,2min后A的浓度减少0.6mol/L,B的浓度减少1.8mol/L,而C的浓度增加1.2mol/L,所以根据物质的变化量之比是相应的化学计量数之比可知,该反应的方程式是A(g) + 3B(g) 2C(g)。反应达平衡时,A的转化率为0.6÷1.0=0.6,即60%。
2C(g)。反应达平衡时,A的转化率为0.6÷1.0=0.6,即60%。
(2)2min内物质A的浓度变化了0.6mol/L,所以反应物A的平均反应速率为0.6mol/L÷2min=0.3 mol/(L﹒min)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是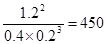 。
。
(3)根据图像可知,a b过程中正逆反应速率都是增大的,但平衡不移动。由于反应是体积减小的可逆反应,所以改变的条件只能是使用了催化剂;b c过程中逆反应速率逐渐增大,而正反应速率突然增大,然后逐渐再降低,平衡向正反应方向移动,所以改变的条件是增加A或B(或反应物)浓度。
(4)由于反应过程中容器容积和温度是不变的,则要使平衡等效,则根据化学方程式换算之后最初的A和B的物质的量必须分别等于1mol和3mol。2molC就相当于是1molA和3molB,题意选项④正也相当于是1molA和3molB,而选项①和③是等效的,因此正确的答案选②④。
