问题
选择题
在密闭容器中,反应A(g)+2B(g) C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
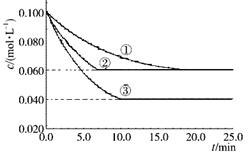
A.若反应①、②的平衡常数分别为K1、K2则K1<K2
B.反应A(g)+2B(g)  C(g)的ΔH >0
C(g)的ΔH >0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)="0.060" mol·L-1
答案
答案:B
题目分析:反应①、②起始和平衡时c(A)均相同,达到平衡需要的时间②比①短,说明②中使用了催化剂,K相等,A错误;
反应①或②:
A(g)+2B(g) C(g)
C(g)
起始(mol/L) 0.1 0.2
平衡(mol/L) 0.06 0.12 0.04
K=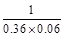 。
。
反应③:
A(g)+2B(g) C(g)
C(g)
起始(mol/L) 0.1 0.2
平衡(mol/L) 0.04 0.08 0.06
K=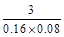 。
。
反应③比反应①平衡常数大而且反应速率快,所以反应③比反应①温度高,正反应是吸热反应,B正确;
实验②平衡时B的转化率为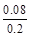 ×100%=40%,C错误;
×100%=40%,C错误;
减小反应③的压强,平衡向左移动,若使c(A)="0.060" mol·L-1则与①是等效平衡,但①、③温度不同,不可能是等效平衡,D错误。
点评:平衡常数只与温度有关。
