探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol ·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
(1)写出计算CuSO4·5H2O质量分数的表达式w=_______________;
(2)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(1)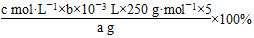 (2)c
(2)c
根据题意可知,Cu2+~H2Y2-,发生反应的EDTA的物质的量为c mol·L-1×b/1 000 L,所以20 mL该溶液中含有的CuSO4的物质的量为c mol·L-1×b/1 000 L,样品中含有的CuSO4·5H2O的质量为(c mol·L-1×b/1 000 L×250 g·mol-1×5),所以CuSO4·5H2O的质量分数为
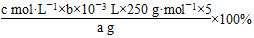 。根据CuSO4·5H2O的质量分数表达式可知,未干燥锥形瓶,对CuSO4的物质的量的测定无影响,所以a无影响;滴定终点时滴定管的尖嘴部分产生气泡,则实际消耗的EDTA溶液的体积比读出来的数值大,即b值偏小,所以CuSO4·5H2O含量偏低;若未除净可与EDTA反应的离子,则消耗的EDTA溶液的体积偏大,即b值偏大,CuSO4·5H2O的含量偏高,C项正确。
。根据CuSO4·5H2O的质量分数表达式可知,未干燥锥形瓶,对CuSO4的物质的量的测定无影响,所以a无影响;滴定终点时滴定管的尖嘴部分产生气泡,则实际消耗的EDTA溶液的体积比读出来的数值大,即b值偏小,所以CuSO4·5H2O含量偏低;若未除净可与EDTA反应的离子,则消耗的EDTA溶液的体积偏大,即b值偏大,CuSO4·5H2O的含量偏高,C项正确。
